Ejercicios de reacciones químicas
Ejercicio 1
Se hacen reaccionar 100 gramos de NO con 120 gramos de O2 para obtener NO2. Calcular la cantidad de NO2 que se obtiene.Respuesta
Balanceamos la ecuación química: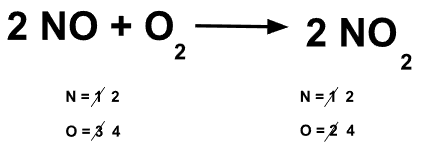
Calculamos la masa molar de los reactivos y productos:
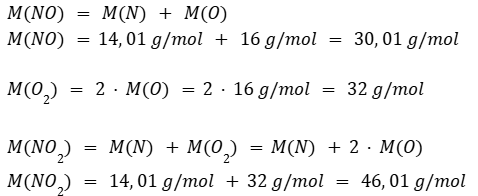
Calculamos la masa de NO equivalente a dos moles ya que dos es el coeficiente de esa molécula en la ecuación química.
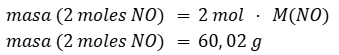
Calculamos la masa de un mol de O2 ya que uno es el coeficiente de esa molécula en la ecuación química.
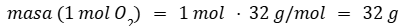
Por regla de tres calculamos la masa de O2 necesaria para que reaccione la totalidad de NO2.
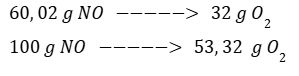
Se necesitan 53,32 g de O2 para que reaccione todo el NO. Dado que se tienen 120 g de O2 se puede afirmar que el reactivo limitante es NO.
Calculamos la masa de dos moles de NO2.
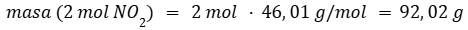
Por regla de tres calculamos el producto obtenido a partir del reactivo limitante.
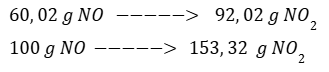
Ejercicio 2
Se hacen reaccionar 135 gramos de P4O10 con 100 gramos de H2O para obtener H3PO4. Calcular la cantidad de H3PO4 obtenida.Respuesta
Balanceamos la ecuación química: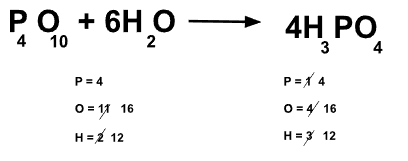
Calculamos la masa molar de los reactivos y productos:

Calculamos la masa de un mol de P4O10 ya que uno es el coeficiente estequiométrico de esa molécula.
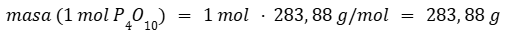
Calculamos la masa de seis moles de agua ya que seis es el coeficiente estequiométrico de esa molécula.
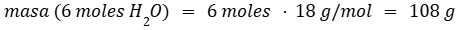
Por regla de tres calculamos la cantidad de H2O para que reaccione completamente el P4O10.
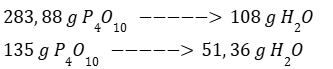
Se requieren 51,36 g de H2O y se tienen 100 g por lo que el reactivo limitante es P4O10.
Calculamos la masa de cuatro moles de H3PO4.
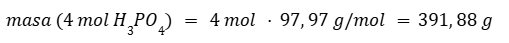
Por regla de tres calculamos el producto obtenido a partir del reactivo limitante.
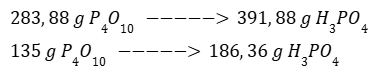
Volver a reacciones químicas
Volver a home